Vol. 2° - XXVIII.8.7.
Formazione della melanina
Per catalisi ossidativa della tirosina da parte della tirosinasi si ha
la formazione di dopachinone dotato di elevata reattività
chimica, il quale, una volta formato, dà luogo a una serie di trasformazioni
spontanee, incluso lo scambio ossidoriduttivo con ciclizzazione ossidativa e
polimerizzazione. La reazione prevalente dipende dall’ambiente biochimico
dei compartimenti melanogenetici che si trovano sotto controllo genetico.
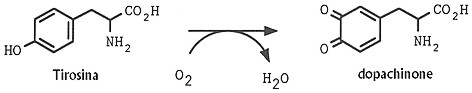
Fig. XXVIII. 2. –
Conversione aerobica della tirosina in dopachinone
catalizzata dalla
tirosinasi
Nei melanociti deputati alla sintesi di eumelanina gran
parte del dopachinone viene convertito in leucodopacromo rapidamente ossidato
in dopacromo per una reazione di scambio ossidoriduttivo con lo stesso
dopachinone. Una certa quota di dopa è costantemente presente nei melanociti
attivi a dispetto del fatto che la tirosinasi possa ossidare la dopa più
rapidamente della tirosina.
Il riarrangiamento in vivo del dopacromo è sotto il
controllo regolativo della dopacromo tautomerasi (DT) che dirige la reazione
verso la formazione di DHICA piuttosto che di DHI. Ioni metallici,
specialmente il rame bivalente, sono in grado di catalizzare il
riarrangiamento non decarbossilativo del dopacromo a DHICA tanto quanto la
DTasi. Da questo si deduce che l’accumulo di ioni metallici nei melanociti
non è il puro risultato della capacità legante delle melanine nei loro
confronti, bensì una caratteristica intrinseca delle cellule pigmentarie che
può giocare un suo ruolo funzionale nella melanogenesi.
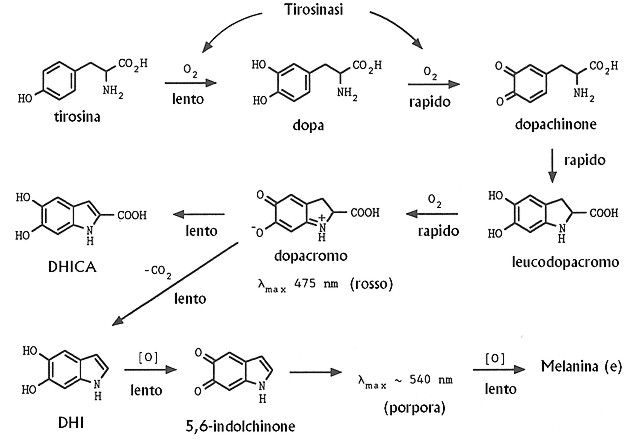
Fig. XXVIII. 3. – Il classico schema della melanogenesi secondo Raper-Mason
Dal momento che nei melanociti sono presenti sia la DTasi
che ioni metallici, si è cercato di discriminare i loro effetti nella
cinetica del riarrangiamento del dopacromo, ma le conclusioni non sono
risolutive, anche se vien da pensare che non si tratti di un’azione che
escluda l’altra, nonostante l’enzima porti prevalentemente alla
conversione del dopacromo in DHICA, mentre gli ioni metallici diano
inevitabilmente origine a una quantità significativa di DHI. Gli ioni
metallici, specie il rame, sono inoltre dotati di altre attività catalitiche
(pseudocatalasica, pseudoperossidasica) che possono rivestire una certa
importanza nella successiva polimerizzazione dei due indoli.
Quest’ultimo passaggio è stato tradizionalmente
considerato come il terzo punto d’intervento della tirosinasi, ma,
considerando la spiccata tendenza dei DHI ad andare incontro a ossidazione,
bisogna desumere che non è richiesta un’elevata specificità dell’enzima
cointeressato. Infatti la perossidasi è molto più efficiente della
tirosinasi nel promuovere la conversione ossidativa del DHI a melanocromo che
avviene quasi istantaneamente. Ancor più strabiliante è la differenza
esistente nell’efficienza relativa dei due enzimi quando il substrato è
rappresentato dal DHICA, scarsamente ossidabile da parte della tirosinasi.
Esistono elevate probabilità che la perossidasi possa giocare un ruolo
critico anche nella sintesi delle feomelanine, agendo in particolare sulla
polimerizzazione ossidativa delle cisdopa che, come il DHICA, rappresentano un
substrato di poco conto per la tirosinasi, a meno che nella miscela non sia
presente un ossidoriduttore ciclico come la dopa.
Per verificare questi dati di laboratorio è stata
riesaminata la distribuzione della perossidasi nei diversi compartimenti
subcellulari dei melanociti di melanoma del criceto. Il livello più elevato
di attività perossidasica è stato trovato in corrispondenza degli stadi 2°
e 3° dei premelanosomi quando comincia a far la sua comparsa la deposizione
di pigmento. Al contrario, nel melanoma amelanotico l’attività
perossidasica non è presente in modo significativo.
La correlazione tra grado di pigmentazione cutanea ed entità di attività tirosinasica è un vecchio concetto che non si dimostra più molto convincente.
Già
nel 1948 si era visto che composti dotati di radicali -SH erano in grado di
inibire l’ossidazione della tirosina in melanina catalizzata dalla
tirosinasi. Il composto è il tripeptide glutatione (GTH) contenente cisteina,
i cui livelli insieme a quelli della GSH reduttasi sono più bassi nella pelle
scura che in quella chiara. Dapprima si suppose che i gruppi sulfidrile -SH
inibissero la tirosinasi legandosi agli ioni rame presenti nei siti attivi
dell’enzima, ma ciò non è vero in quanto il GSH è dotato della capacità
di reagire con il dopachinone per formare composti incolori, le GS-dopa
(glutationil S dopa), successivamente trasformate nelle corrispondenti cisdopa
per intervento della g-glutamiltrasferasi e peptidasi,
presenti nei melanociti come pure in elevata quantità nel fegato e nel rene.
Soprattutto, la
formazione e il metabolismo delle GS-dopa forniscono un meccanismo
molto interessante per il ruolo di regolazione nella pigmentazione della cute.
Nella pelle scura, caratterizzata da un basso contenuto in composti
sulfidrilici, l’ossidazione della tirosina da parte della tirosinasi conduce
alla formazione del dopachinone che è ampiamente convertito in dopacromo e
quindi in melanina.
Nella pelle chiara non irradiata, con un contenuto
relativamente alto in sulfidrili, gran parte del dopachinone che si genera per
intervento enzimatico viene convertito in molecole di glutationildopa, sicché
la formazione di dopacromo è scarsa o nulla, e perciò anche la formazione di
melanina. Gli stimoli pigmentogenetici, come la luce solare o la combinazione
psoralene+ultravioletto A (PUVA), hanno come effetto l’ossidazione del
glutatione nel suo disulfile, per cui si determina un aumento della quota di
dopachinone disponibile per la melanogenesi. Si può pertanto concludere
dicendo che
la
marcata differenza circa il colore del pigmento
risiede in una differenza su base genetica dei livelli di GSH
e non nel tipo di melanociti presenti.